티스토리 뷰
목차
반응형
원소의 주기적 성질
(1) 유효 핵전하
① 유효핵전하: 전자에 작용하는 실질적인 핵전하
- 수소 원자는 전자가 1개, 전자 사이의 반발력 없고, 원자핵과 전자 사이의 인력만 존재. 수소 원자에서 전자에 작용하는 유효 핵전하는 양성자수에 의한 핵전하와 같은 1+
- 전자가 2개 이상인 다전자 원자의 전자에 작용하는 실질적인 핵전하는 원자핵과 전자 사이의 인력과 전자 사이의 반발력도 고려. 한 전자에 작용하는 유효 핵전하는 다른 전자와의 반발력 때문에 양성자수에 의한 핵전하보다 작다. (원자 번호가 6인 탄소(C)원자의 경우 원자가 전자에 작용하는 유효 핵전하는 양성자수에 의한 핵전하인 6+보다 작다)
② 가려막기 효과(가림 효과)
- 다전자 원자에서 전자에 작용하는 유효 핵전하가 양성자수에 의한 핵전하보다 작아지는 것은 다른 전자에 의해 핵이 가려지기 때문. 자신보다 안쪽 전자 껍질에 있는 전자뿐만 아니라 자신과 같은 전자 껍질에 있는 다른 전자에 의해서도 나타난다.
- 가려막기 효과는 전자 사이의 반발력 때문에 원자핵과 전자 사이의 실질적인 인력이 약해지는 현상
- 같은 전자 껍질에 있는 전자에 의한 가려막기 효과는 안쪽 전자 껍질에 있는 전자에 의한 가려막기 효과보다 작다.
③ 같은 주기에서 원자 번호에 따른 원자가 전자가 느끼는 유효 핵전하
- 같은 주기에서는 원자번호가 클수록 원자가 전자가 느끼는 유효 핵전하가 커집니다.
- 양성자가 1개 많아지면 양성자수에 의한 핵전하는 1 증가하고 전자도 1개 많아지므로 가려막기 효과도 증가합니다. 하지만 양성자수 증가에 따른 핵전하의 증가가 전자수 증가에 따른 가려막기 효과의 증가보다 크기 때문에 원자가 전자가 느끼는 유효 핵전하는 증가 합니다.

④ 같은 족에서 원자 번호에 따른 원자가 전자가 느끼는 유효 핵전하
- 같은 족에서 원자 번호가 클수록 원자가 전자가 느끼는 유효 핵전하는 증가 합니다. 이는 양성자 수 증가가 전자수 증가에 따른 가려막기 효과의 증가보다 크기 때문입니다.
⑤ 전자수 증가와 감소에 따른 원자가 전자가 느끼는 유효 핵전하
- 전자수 증가: 전자들 사이의 반발력이 커져서 유효 핵전하가 감소됩니다. (F > F^-)
- 전자수 감소: 전자들 사이의 반발력이 작아져 유효 핵전하가 증가합니다.(Na < Na^+)
(2) 원자 반지름
① 원자 반지름에 영향을 주는 요인
- 전자 껍질수 : 같은 족에서는 원자 번호가 증가할수록 전자껍질수가 증가하며, 전자껍질수가 많아질수록 원자가 전자와 핵 사이의 거리가 멀어지므로 원자 반지름이 커집니다. (Li < Na)
- 유효 핵전하: 같은 주기에서는 원자 번호가 증가할수록 원자가 전자가 느끼는 유효 핵전하가 증가하며, 유효 핵전하가 커질수록 원자가 전자 사이의 전기적 인력이 증가하므로 원자 반지름이 작아집니다. (Li > Be)
② 원자 반지름의 주기적 변화 (18족 원소 제외)

- 같은 족 : 원자 번호가 증가할수록 전자껍질수가 증가하므로 원자반지름이 커집니다.
- 같은 주기 : 원자 번호가 증가할수록 원자가 전자가 느끼는 유효핵전하가 증가하므로 원자 반지름이 작아집니다.
(3) 이온 반지름
| 양이온 반지름 | 금소 원소의 원자가 비활성 기체와 같은 전자 배치를 갖는 양이온이 되면 전자 껍질 수가 감소하므로 이온 반지름은 원자 반지름보다 작아진다. (Na > Na^+) |
| 음이온 반지름 | 비금속 원소의 원자가 비활성 기체와 같은 전자 배치를 갖는 음이온이 되면 전자 수가 증가하여 전자 사이의 반발력이 증가하고, 가려막기 효과가 커져서 유효 핵전하가 감소하므로 이온 반지름이 원자반지름보다 커집니다. (Cl < Cl^-) |
① 이온 반지름의 비교
- 같은 족 원소의 이온 반지름 : 원자 번호가 증가할수록 전자 껍질 수가 증가하므로 이온 반지름이 커진다. (Li^+ <Na^+, F^- < Cl^-)
- 같은 주기 원소의 양이온과 음이온 반지름 : 양이온은 같은 주기 원소의 음이온보다 전자껍질이 1개 적기 때문에 반지름이 작다. (Na^+ < Cl^-)
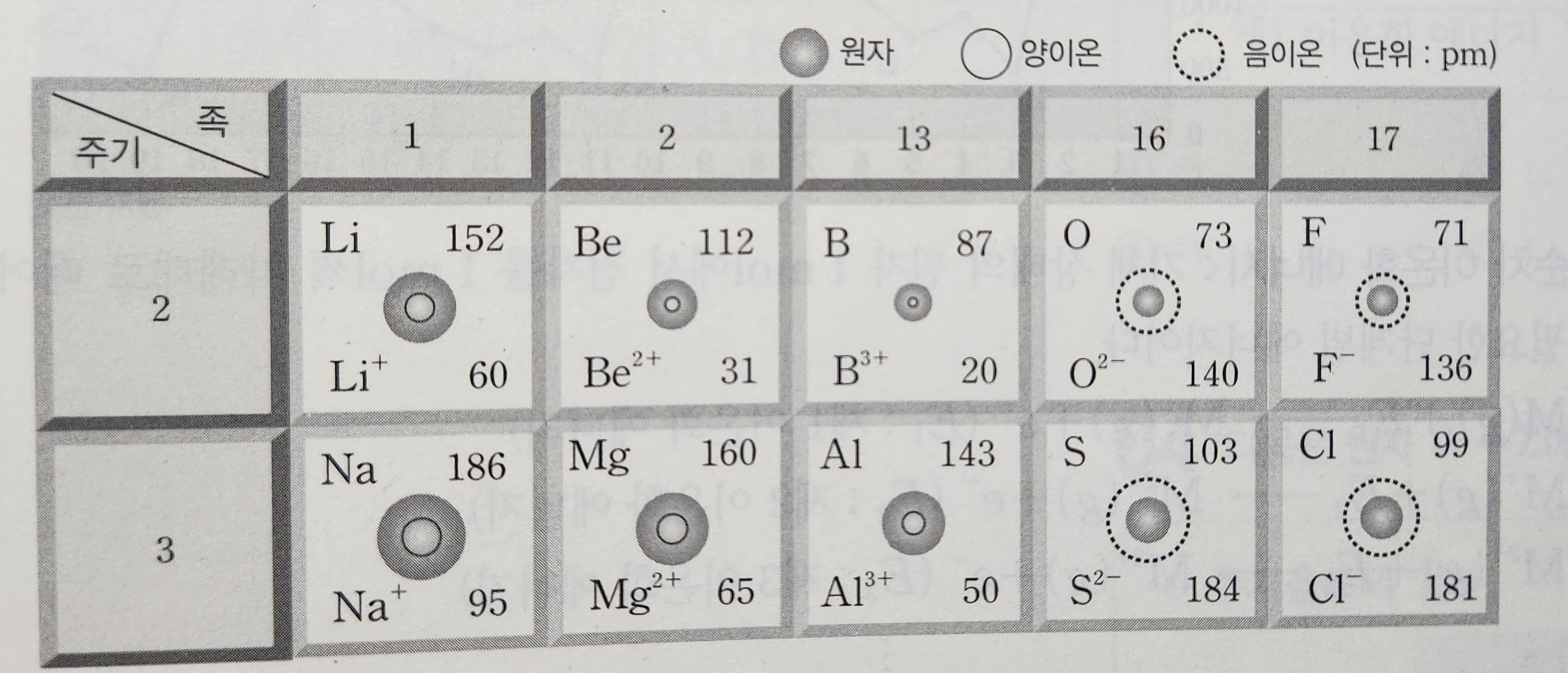
② 전자수가 같은 이온(등전자 이온)의 이온 반지름
- 전자 수가 같은 이온의 경우 원자 번호가 클수록 유효 핵전하가 크므로 이온 반지름이 작아집니다.
- O^2- > F^- > Na^+ > Mg^2+ > Al^3+
- S^2- > Cl^- > K^+ > Ca^2+
(4) 이온화 에너지
- 기체 상태의 원자 1 mol에서 전자 1 mol을 떼어 내어 기체 상태의 +1가 양이온 1 mol로 만드는데 필요한 에너지입니다.
- 이온화 에너지가 작을수록 전자를 떼어 내기가 쉬워지므로 양이온이 되기 쉽습니다.
① 이온화 에너지의 주기적 변화
- 같은 족 : 원자 번호가 증가할수록 전자껍질수가 증가하여 핵과 원자가 전자 사이의 거리가 멀어 전기적 인력이 작아지므로 이온화 에너지가 감소합니다.
- 같은 주기: 원자번호가 증가할수록 원자가 전자가 느끼는 유효 핵전하가 증가하여, 핵과 원자가 전자 사이의 전기적 인력이 커지므로 이온화 에너지가 대체로 증가합니다. 1족 원소의 이온화 에너지가 가장 작고, 18족 원소의 이온화 에너지가 가장 크다
- 2, 3주기에서 2족에서 13족으로 될때, 15족에서 16족으로 될 때는 이온화 에너지가 감소합니다.
- 2주기 원소의 이온화 에너지 : Li < B < Be < C < O < N < F < Ne
- 3주기 원소의 이온화 에너지 : Na < Al < Mg < Si < S < P < Cl < Ar

② 순차 이온화 에너지 :
기체 상태의 원자 1 mol에서 전자를 1 mol 씩 차례대로 떼어내는데 필요한 단계별 에너지입니다.
- 전자를 떼어 낼수록 이온의 전자수가 감소하기 때문에 전자 사이의 반발력 감소, 가려막기 효과 감소, 유효 핵전하 증가하여 순차 이온화 에너지는 차수가 커질수록 증가합니다.
- 순차 이온화 에너지 변화와 원자가 전자수 결정: 원자가 전자를 모두 떼어 낸 후, 그 다음 전자를 떼어 낼 때는 안쪽 전자껍질에서 전자가 떨어지게 되어 순차 이온화 에너지가 급격히 증가하게 됩니다. 따라서 순차 이온화 에너지가 급격히 증가하기 직전까지 떼어 낸 전자수는 원자가 전자수와 같습니다.
반응형
